Survival analyse: Difference between revisions
No edit summary |
|||
| Line 64: | Line 64: | ||
= Referenties = | = Referenties = | ||
*[http://www.bmj.com/cgi/reprint/328/7447/1073 Bland, M.J. and Altman, D.G, 2004. Statistical Notes - The log rank test, BMJ Vol 328 may 2004] | |||
*Hosmer, D. W., and S. Lemeshow. 1999. Applied Survival Analysis. New York: John Wiley and Sons. | *Hosmer, D. W., and S. Lemeshow. 1999. Applied Survival Analysis. New York: John Wiley and Sons. | ||
*Kleinbaum, D. G. 1996. Survival Analysis: A Self-Learning Text. New York: Springer-Verlag. | *Kleinbaum, D. G. 1996. Survival Analysis: A Self-Learning Text. New York: Springer-Verlag. | ||
Revision as of 15:40, 28 December 2009
Survival analyse wordt gebruikt voor data die informatie geeft over de tijd tot het optreden van een bepaald event. Met tijd wordt in deze bedoeld het aantal jaren, maanden of weken vanaf de start van de follow-up van een patient tot aan het optreden van een event. Het event kan overlijden zijn (vandaar de naam survival analyse), maar ook een relapse, herstel of een ander helder gedefinieerd eindpunt. In het algemeen wordt er bij survival analyse vanuit gegaan dat er maar één type risico is en dat een event per individu maar hoogstens één keer kan optreden. Bij meerdere risico's of meerdere herhalingen van een event zijn meer geavanceerde analyse technieken nodig zoals recurrent event analyse of competing risk analyse.
Bij het meten van tijd-tot-event data is vaak sprake van gecensureerde waarnemingen. Hierbij heb je iets aan informatie over de 'survival time' van een patient, maar weet je niet precies hoe lang de tijd-tot-event is. Een voorbeeld. Stel dat in een studie patienten over een periode van twaalf weken gevolgd worden. Censurering (Eng.: censoring) kan op drie manieren optreden:
- Een patient is gevolgd vanaf het begin van de studie tot aan het eind van de 12 weekse studie periode. Op dat moment heeft de patient het event nog niet gekregen. We weten nu alleen dat de tijd-tot-event van deze persoon langer is dan 12 weken.
- Een patient trekt zich terug uit de studie na 6 weken, dus voor het eind van de studieperiode. Van deze persoon weten we alleen dat de tijd-tot event langer is dan 6 weken. Of een patient start aan de studie maar raakt na het laatste contact op 8 weken 'lost to follow up'. Ook van deze patient weten we alleen dat de eventvrije periode langer is dan 8 weken.
- Een patient kan niet tot het einde gevolgd worden doordat hij een ander type event krijgt. Bijvoorbeeld: we onderzoeken tijd tot relapse na operatie, maar een patient overlijdt tijdens de studie zonder een relapse gehad te hebben.
Kaplan Meier analyse
Wanneer gebruik ik een Kaplan Meier analyse?
Om de tijd tot het optreden van het event voor de gehele steekproef te kwantificeren, wordt er vaak een Kaplan Meier analyse gebruikt. De Kaplan Meier analyse is een niet-parametrische aanpak. Dat wil zeggen dat er geen aanname gedaan wordt ten aanzien van het soort verdeling (normaal, gamma etc.) van de event tijden. Toch zitten er wel een paar aannames achter deze methode:
- De prognose van patienten die vroeg of laat zijn geïncludeerd in de studie is gelijk.
- Patienten die gecensureerd zijn op een bepaald tijdstip hebben dezelfde prognose als patienten die op datzelfde tijdstip wel in de studie zijn gebleven (en op dat moment nog geen event hebben gehad). Er wordt niet aan deze aanname voldaan als bijvoorbeeld personen met een grote kans op een event vlak voordat het event optreedt de studie verlaten.
- De tijdstippen waarop de events optreden zijn exact bekend.
- Patienten worden vanaf het begin van de onderzochte periode gevolgd. Als er bijvoorbeeld pas 10 dagen na interventie gestart wordt met het volgen van survival stutus van patienten, dan zullen patienten die in de eerste 10 dagen reeds overleden zijn niet vertegenwoordigd zijn in de studie. Een Kaplan-Meier analyse geeft dan geen goede inschatting van de echte survival tijd. Survival modellen die rekening houden met dit verschijnsel worden late entry survival modellen genoemd.
De basis gedachte achter de Kaplan Meier procedure is het opdelen van de tijdsschaal. Op ieder moment dat er bij één of meerdere patienten een event optreedt, wordt de kans daarop geschat door het aantal events op dat moment te delen door het aantal personen dat op dat moment nog in de studie zit (i.e. niet eerder al een event heeft gehad of gecensureerd is). De survival functie (of cumulatieve proportie van 'survivors') combineert deze schattingen over alle tijdstippen. Op deze manier wordt het resultaat minimaal beïnvloed door patienten die halverwege de rit gecensureerd raken. Een Kaplan-Meier analyse resulteert in een 'life table' en een survival curve.
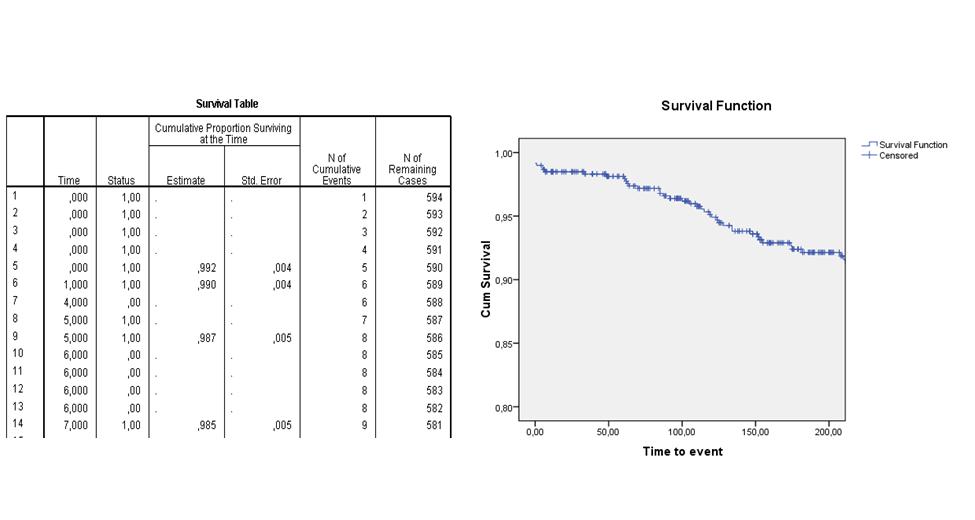
De volgende life table en survival curve laten bijvoorbeeld zien wat de verwachte overlevingskans is van patienten die een dotterbehandeling hebben ondergaan. Je ziet in de tweede kolom ("Time") van de life table dat er op dag 4 en dag 6 patienten gecensureerd raakten en dat er op dag 0 vijf events waren, op dag 1 een event, op dag 5 twee events en dag 7 een event optrad. Op de dagen dat er een event optrad, is de cumulatieve survival berekend. In de survival curve zie je de geschatte survival functie over de eerste 200 dagen na interventie. Na 200 dagen wordt de kans op overleven geschat op ongeveer 92%.
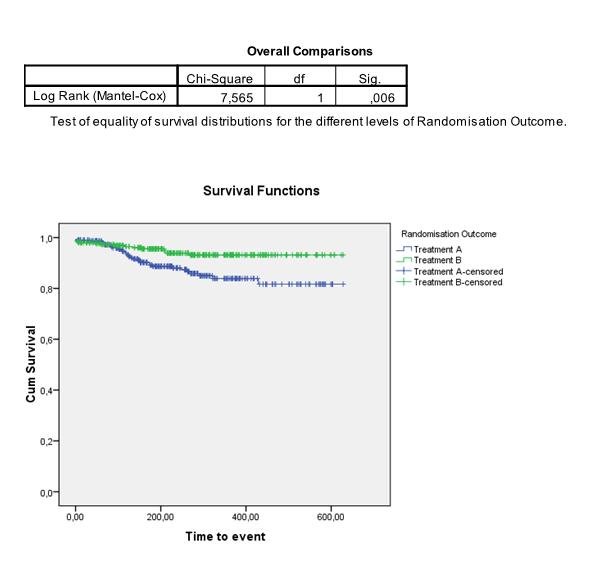
Hoe test ik of Kaplan Meier survival curves van elkaar verschillen?
We kunnen de curves ook apart schatten en vergelijken voor twee (of meer) subgroepen in onze data. Om te testen of de Kaplan Meier curves van 2 (of meer) groepen significant van elkaar verschillen, wordt vaak de log-rank test gebruikt. Hierbij is de nulhypothese dat de curves niet van elkaar verschillen. De test vergelijkt de geobserveerde verschillen tussen de survival curves met verschillen die zouden kunnen ontstaan als er geen verschil is tussen de groepen. In het volgende voorbeeld concluderen we bijvoorbeeld dat het verschil tussen treatment A en treatment B significant is:
Kan ik meerdere aparte Kaplan Meier curves bij elkaar in 1 grafiek plotten?
Voor een paper heb ik 3 kaplan meier curves die op de x-as allemaal even ver lopen (allemaal een tijdsduur van 27 maanden). Ik wil deze 3 curves in 1 plot zetten. Kan dat met SPSS en zo ja, hoe?
We zijn er zelf uitgekomen en wel op de volgende manier: In ons geval wilden wij 3 verschillende curves (survival, grote amputatie en kleine amputatie) in 1 KM grafiek zetten. We hebben de data opnieuw gerangschikt. 1 variable met time to event, 1 variable met event status (alledrie de events hadden status 1), en een nieuwe onderscheidende variable die duidelijk maakte dat de eerste time to event en event zelf sloeg op survival, tweede time to event en event zelf op grote ampuatie en drede time to event en event zelf op kleine amputatie. Invoeren gewoon time to event en event status en de nieuwe onderscheidende variable wordt de 'factor'. Mocht iemand anders ooit nog met hetzelfde probleem zitten, bij deze de oplossing.
Waar vind ik de Kaplan Meier analyse in SPSS?
Je vindt de Kaplan Meier analyse in SPSS 16 onder Analyze -> Survival -> Kaplan-Meier.
Cox regressie
Wanneer gebruik ik een Cox proportional hazards model?
Wanneer er bij een survival analyse slechts één voorspellende factor onderzocht wordt die slechts een paar mogelijke waardes kan aannemen, kan een Kaplan Meier analyse volstaan. Zijn er echter meerdere factoren die de overleving kunnen beinvloeden, dan is een uitgebreider model nodig. Een veel gebruikt model is het Cox proportional hazards model. Hiermee kun je net als met andere multivariabele regressie modellen meerdere voorspellers tegelijk bestuderen. Voordeel van het Cox model boven een Kaplan Meier analyse is bovendien dat er naast de vraag "is er een effect" ook antwoord gegeven wordt op de vraag "hoe groot is het effect" van een bepaalde voorspeller. Het Cox model geeft de grootte van een effect weer met behulp van hazard ratio's (HR), waarbij een HR van 1 aangeeft dat er geen verschil is. De hazard is de instantane kans om een event te krijgen, en een hazard ratio is vergelijkbaar met een relatief risico. Bijvoorbeeld: "During the 20-year follow-up, 83 women developed lung cancer. There was a moderate association between hormone use and lung cancer (hazard ratio, 1.13; 95% CI, 1.08-1.73)."
Het Cox model maakt een belangrijke aanname: de proportional hazards assumptie. Deze zegt dat de HR's constant zijn in de tijd. Dit betekent dat het relatieve verschil in hazard veroorzaakt door verschillende waardes van een voorspeller gelijk blijft in de tijd. Er wordt in het bovenstaande voorbeeld dus vanuit gegaan dat het wel of niet gebruiken van hormonen een zelfde invloed heeft na 1 jaar als na 20 jaar follow up: op ieder tijdstip wordt de kans op het optreden van longkanker bij hormoongebruik 1.13 keer hoger geschat dan dezelfde kans als er geen hormonen werden gebruikt.
Hoe test ik de proportional hazards aanname binnen een Cox model?
Er zijn meerdere manieren om de PH aanname van een Cox model te testen:
- Grafisch
Als een variabele in het model voldoet aan de proportional hazards (PH) aanname, dan zullen de geschatte overlevingscurves, op de zogenaamde log-schaal, voor de waardes van deze variabele parallel lopen. Je kunt hier naar kijken door in het cox model de variabele voor welke je de PH aanname wilt onderzoeken niet meer als covariaat, maar als stratum mee te geven en te vragen om log minus log survival plots. De resulterende lijnen moeten op het oog parallel lopen (zeker elkaar niet kruisen) om te voldoen aan de PH aanname voor deze variabele. Voor iedere variabele in het model is een dergelijke plot nodig. In deze voorbeeldsyntax kun je zien hoe het maken van een log minus log plot er in SPSS syntax uit komt te zien.
- Testen van (Schoenfeld) residuen
Er kan een formele test gedaan worden mbv Schoenfeld residuen. Er is geen standaard functie hiervoor in SPSS. In Stata (functie estat phtest) of R (functie cox.zph) kan het wel direct.
- Toevoegen van een tijdsafhankelijke variabele
Anticiperend op het mogelijk niet voldoen aan de PH aanname kun je ook een time dependent Cox model draaien met daarin een tijdsafhankelijke variabele opgenomen (bijvoorbeeld GENDER*T). Als deze tijdsafhankelijke variabele significant bijdraagt aan het model, is er blijkbaar niet aan de PH aanname voldaan.
Waar vind ik het Cox proportional hazards model in SPSS?
Je vindt de Kaplan Meier analyse in SPSS 16 onder Analyze -> Survival -> Cox Regression of Cox w./ Time Dep Cov.
Referenties
- Bland, M.J. and Altman, D.G, 2004. Statistical Notes - The log rank test, BMJ Vol 328 may 2004
- Hosmer, D. W., and S. Lemeshow. 1999. Applied Survival Analysis. New York: John Wiley and Sons.
- Kleinbaum, D. G. 1996. Survival Analysis: A Self-Learning Text. New York: Springer-Verlag.
- Norusis, M. 2004. SPSS 13.0 Advanced Statistical Procedures Companion. Upper Saddle-River, N.J.: Prentice Hall, Inc..
Terug naar OVERZICHT voor een overzicht van alle statistische onderwerpen op deze wiki.
Terug naar KEUZE TOETS voor hulp bij het uitzoeken van een geschikte toets of analyse.