Randomiseren
Definitie
Randomisatie is een techniek waarmee proefpersonen op basis van toeval (loting) worden toegewezen aan de interventie of controle groep van een experimenteel onderzoek.
Wat is randomiseren?
Een randomized controlled trial (RCT) is de gouden standaard voor het evalueren van interventies in de gezondheidszorg. De basis van het studiedesign is dat proefpersonen op basis van toeval (at random) worden toegewezen aan een van de studiearmen. Het beoogde resultaat is een gelijke verdeling van de eigenschappen van bekende en onbekende prognostische factoren over de studiearmen. Na randomisatie verwacht je dat het effect van het natuurlijk beloop, placebo effecten, confounders en meetfouten in beide groepen tegen elkaar wegvallen. Hierdoor meet je uiteindelijk alleen het “netto” effect van de interventie als verschil tussen de interventie en de controle groep.
Wanneer randomiseren?
In experimenteel onderzoek waarbij twee of meer groepen worden vergeleken en waarin de onderzoeker de interventie kan manipuleren en op deze wijze invloed zou kunnen hebben op de toewijzing van de interventie of op de behandeling van de proefpersonen.
Waarom randomiseren?
Er zijn drie redenen om te randomiseren:
Ten eerste
Idealiter bestaat het verschil tussen de armen van een studie alleen uit het effect van de therapie, de interventie. Door te randomiseren worden alle andere factoren die het therapie effect kunnen beïnvloeden door het toeval verdeeld over de beide groepen. Dit zorgt ervoor dat het effect van bekende en onbekende (prognostische) factoren at random wordt verdeeld over beide studiearmen.
Ten tweede
Randomisatie helpt mij bij het blinderen van de interventie voor de behandelaars en de proefpersonen. Het voorkomt dat er patronen van patiëntreacties herkend worden waardoor de toewijzing aan een van de studiearmen bekend wordt aan de behandelaar.
Ten derde
Randomisatie levert groepen op die een willekeurige steekproef zijn van de onderzoekspopulatie waarmee aan een voorwaarde wordt voldaan voor het toepassen van de standaard statistische testen die gebaseerd zijn op kanstheorie.
Wat doet randomisatie niet?
Randomisatie is geen garantie dat prognostische factoren ook werkelijk gelijk verdeeld worden tussen studiegroepen, het toeval kan ongelukkig uitpakken. De kans op een ongelijke verdeling wordt groter naarmate de steekproef kleiner is. Bij een willekeurig grote steekproef zullen prognostische factoren gelijk verdeeld raken.
Welke methoden zijn ongeschikt voor randomisatie?
Er zijn verschillende methoden om patiënten aan een studie arm toe te wijzen die niet gelden als random. Het bezwaar tegen deze methoden is de voorspelbaarheid van de toewijzing. Omdat artsen er naar streven om iedere patient optimaal te behandelen kan er bij een voorspelde toewijzing een conflict ontstaan tussen wat de arts wenselijk acht, op dat moment, onder die specifieke omstandigheden en wat de zorg behorende bij de toegewezen studiearm inhoudt.
Voorbeelden van toewijzing die worden geassocieerd met een hoge mate van voorspelbaarheid zijn: volgens een vaste volgorde (patiënt 1 krijgt A, patiënt 2 krijgt B, patiënt 3 krijgt A etc.); op basis van de datum of dag in de week (patiënt krijgt A op even dagen, B op oneven dagen); op basis van de initialen van de patient (A-K → behandeling A en M-Z → behandeling B). Deze methoden worden sterk afgeraden omdat er makkelijk mee gemanipuleerd kan worden.
Welke software is beschikbaar voor randomisatie?
Het heeft de voorkeur om de randomisatie van een RCT laten ondersteunen door de CRU. Hiervoor wordt het programma ALEA gebruikt. ALEA is een door het Nederlands Kanker Instituut ontworpen applicatie. Dit systeem wordt momenteel door een consortium van 10 Europese universitair medische centra gebruikt. ALEA is gevalideerd voor toepassing in GCP trials. Met Alea kun je de randomisatie procedure on line uitvoeren. Patiënten worden via de ALEA website gerandomiseerd in een eigen afgeschermde studie implementatie. Met ALEA kunnen alle typen gerandomiseerde studies ondersteund worden. De implementatie van een RCT in ALEA gaat via de afdeling databasemanagement van de CRU
http://www.amc-cru.nl/klinischonderzoek.aspx
Als je de randomisatie helemaal in eigen hand wil houden kun je het programma NQUERY gebruiken. In dat programma vindt je onder “Randomize” (de bovenste menubalk) verschillende opties voor het maken van een random tabel.
Je moet daarvoor minimaal de steekproefgrootte en het aantal studiearmen opgeven.
Welke typen randomisatie zijn er?
Er zijn verschillende manieren om te randomiseren, o.a. simpel-, blok-, gestratificeerde randomisatie en minimisatie.
Simpele randomisatie
Bij twee studiearmen is deze methode vergelijkbaar met het opgooien van een munt. In de praktijk werkt het met random getallen. Een behandeling wordt toegewezen volgens een vooraf gestelde regel. Bijvoorbeeld een computer genereert een random getal tussen de 0 en 1. Als dit getal minder of gelijk is aan 0,5 wordt behandeling A toegepast, als het getal meer is dan 0,5 wordt behandeling B toegepast.
Nadeel van deze methode is dat het niet garandeert dat de steekproef precies gelijk over de studiearmen verdeeld zal worden. Op basis van toeval kan er een lange opeenvolging van eenzijdige toewijzing plaatsvinden, bijvoorbeeld AAAABBA. Hoe kleiner de steekproef hoe groter het risico op een ongelijke verdeling is.
Om een ongelijke verdeling tussen de studiearmen te vermijden kun vooraf aan de studie met een computer een lijst met random getallen maken en beoordelen op bruikbaarheid. Als de lijst een ongelijke verdeling heeft van meer dan 10 tussen de studiearmen kun je een nieuwe random getallen lijst genereren. De praktijk leert dat de simpele methode van randomisatie alleen bij een beoogde steekproef van pakweg meer dan 200 toepasbaar is (1).
Blok randomisatie
Het nadeel van simpele randomisatie is de kans op een ongelijke verdeling van het aantal patiënten over de studiearmen . Door te randomiseren in blokken kun je dit vermijden. Een blok krijgt een bepaalde grootte, bijvoorbeeld 4, 6 of 8 waarin beide studiearmen evenredig verdeeld zijn (voorbeeld ABAB of BAAB etc.). Na ieder blok heb je dus een gelijke verdeling over beide studiearmen. De blokgrootte is een veelvoud van het aantal studiearmen in de studie.
Als blokken niet helemaal gebruikt worden kan er alsnog een ongelijke verdeling tussen studiearmen ontstaan. Bijvoorbeeld, als een studie met een blokgrootte van 8 halverwege stopt is de maximale ongelijkheid 4 patiënten.
Kritiek op het gebruik van kleine blokken is dat de randomisatie voor een deel voorspelbaar kan worden. Bij een blokgrootte van 4 is bekend dat er niet meer dan 4 keer dezelfde toewijzing kan volgen, de volgende toewijzing is dus volledig voorspelbaar. Daarom worden er het liefst grote en blokken van random wisselende grootte gebruikt.
Voorbeeld van randomisatie met blokgrootte van 4 ( therapie = A, controle = B) R → ABAB BABA AABB ABBA ABBA ABAB BABA AABB ABBA etc.
In de praktijk wordt blok randomisatie vaak uitgevoerd met behulp van opeenvolgend genummerde gesloten enveloppen. De envelop wordt geopend nadat informed consent is verkregen van de patiënt.
Gestratificeerde randomisatie
Bij simpele of blok randomisatie is het niet gegarandeerd dat bekende prognostische factoren gelijk verdeeld worden over de studiearmen. De kans dat prognostische factoren ongelijk verdeeld worden is bij een kleine steekproef groter dan bij een grote steekproef. Een methode om een ongelijke verdeling van bekende prognostische factoren te voorkomen is gestratificeerde randomisatie. Stratificatie betekent dat voor iedere combinatie van prognostische factoren (voor ieder stratum) een aparte randomisatielijst wordt gebruikt. Gestratificeerde randomisatie wordt vaak gebruikt in combinatie met het blok design om de interventie evenredig over beide studiearmen te verdelen.
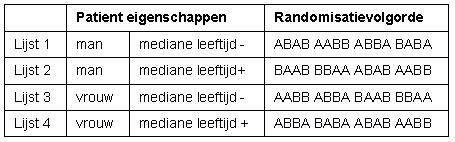
Voorbeeld van een gestratificeerde blok randomisatie waarin gestratificeerd wordt voor geslacht en leeftijdsgroep ( therapie = A, controle = B)
Op basis van de eigenschappen van een patient wordt de juiste lijst gekozen, een man die ouder is dan de mediane leeftijd wordt gerandomiseerd vanuit lijst 2.
Het stratificeren wordt belangrijker naarmate de steekproef kleiner is omdat het risico op een onevenredige verdeling van de prognostische factoren dan groter is. Echter, het aantal randomisatielijsten dat je moet hanteren groeit snel naarmate je met meer prognostische factoren rekening wil houden. Voor je het weet heb je evenveel strata als patiënten in je steekproef. Bij deze methode is evenzogoed een onevenredige verdeling van patiënten aantallen tussen de studiearmen mogelijk (zie blok randomisatie). Hierbij speelt de blokgrootte en het aantal strata een rol. Als in het bovenstaande voorbeeld toevalligerwijs in alle strata de laatste blokken AABB zouden zijn en de studie stopt nadat alleen de AA's zijn gebruikt is de maximale (erg theoretische) scheefheid 8 patiënten.
Als je met meerdere prognostische factoren rekening wilt houden kun je meerdere factoren combineren in een index waarna je de index gebruikt om de strata te definiëren.
Minimisatie
Met minimisatie wordt ook gestreefd naar een gelijke verdeling van patiënten en hun prognostische factoren onder de studiearmen. Het verschil met gestratificeerde blok randomisatie is dat er bij minimisatie geen strata (subgroepen) vooraf worden gedefinieerd van waaruit gerandomiseerd wordt. De minimisatie methode beoordeelt alvorens een nieuwe patient wordt gerandomiseerd hoe zijn of haar verdeling van de prognostische factoren is bij de tot dan toe gerandomiseerde patiënten. Als deze verdeling in balans is wordt de patient gewoon (kop of munt) gerandomiseerd. Als er een onbalans bestaat zal de trekking bewust worden beïnvloed ten gunste van de groep die de onbalans doet verminderen.
Voorbeeld van een randomisatie met de minimisatie methode.
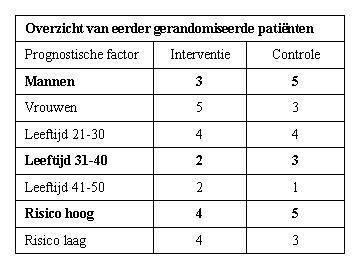
Stel de eerst volgende patient is een man, tussen de 31 en 40 jaar oud met een hoog risico.
In de interventie groep zijn 3 (mannen) + 2 (leeftijd 31-40) + 4 (hoog risico) = 9 patiënten gerandomiseerd.
In de controle groep zijn 5 (mannen) + 3 (leeftijd 31-40) + 5 (hoog risico) = 13 patiënten gerandomiseerd.
Nu zijn er verschillende opties om de patiënt toe te wijzen. Bij een strikte minimisatie wordt de patiënt toegewezen aan de interventie groep omdat 9 < 13. Het nadeel van deze methode is de voorspelbaarheid. Een andere optie is het aanpassen van de kansverhouding op toewijzing, bijvoorbeeld 80:20. De kansverhouding kan je laten bepalen door de mate van onbalans (gebruikelijk). Als groepen in balans zijn vindt de toewijzing plaats op basis van een fifty-fifty kans.
Vragen over randomisatie
Kan ik op volgorde van aanmelding randomizeren ?
Wij gaan een dubbelblinde crossover studie doen. Een groep volwassen patiënten gaat gedurende 2 perioden van 4 weken een extra supplement krijgen wat we ene periode een mogelijk werkzame stof en de andere periode placebo bevat. Aan het eind van beide periodes wordt beeldvorming en neuropsychologisch onderzoek gedaan. Het doel is 20 patiënten te includeren. Graag willen we uw advies over hoe te randomiseren. Er zal een groep 1 zijn, die eerst het blauwe supplement en in de tweede periode het groene supplement krijgt, en er is een groep 2 die eerst het groene supplement en in de tweede periode het blauwe supplement krijgt. Mijn voorstel zou zijn om te randomiseren in volgorde van aanmelding waarbij de oneven nummers (1e, 3e, 5e aanmelding etc) in groep 1 gaan en de even nummers (2e 4e 6e etc) aanmelding in groep 2. Is dit een juiste methode of zijn er valkuilen?
Om en om randomiseren is altijd een beetje gevaarlijk omdat dan makkelijk de blindering doorbroken kan worden (als je eenmaal weet dat nr 5 groen heeft gekregen weet je alle opeenvolgende toewijzingen ook gelijk!). Het handigst om de 1e 20 pats te randomiseren mbv een randomisatieprogramma. Degene die het middel moet gaan geven, mag niet weten of dit groen of blauw is. Bij de tweede (cross-over) periode moet de 'randomisator' alle groene op blauw overzetten en vice versa. Wederom blijft de behandelaar blind.
Referenties
1. Pocock SJ. Allocation of patients to treatment in clinical trials. Biometrics 1979; 35: 183-197
Terug naar OVERZICHT voor een overzicht van alle statistische onderwerpen op deze wiki.
Terug naar KEUZE TOETS voor hulp bij het uitzoeken van een geschikte toets of analyse.